Směsi
SMĚSI
Směsi jsou látky, které se skládají ze dvou a více chemických látek, které nazýváme složky. Mezi složkami nedochází k chemickým reakcím. Fyzikální vlastnosti směsi a jejich jednotlivých složek mohou být odlišné.
Třídění směsí
Směsi třídíme podle velikosti částic na:
1) Stejnorodé (homogenní, roztoky,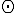 ) - částice jednotlivých složek nelze rozeznat okem, lupou ani mikroskopem.
) - částice jednotlivých složek nelze rozeznat okem, lupou ani mikroskopem.2) Různorodé (heterogenní) - částice jednotlivých složek můžeme rozeznat okem, lupou nebo mikroskopem.
Třídění stejnorodých směsí
Stejnorodé směsi dělíme podle skupenství na:
- pevné - např. sklo, slitiny kovů;
- kapalné - např. mořská voda, čaj, směs vody a lihu;
- plynné - např. zemní plyn, vzduch.
Třídění různorodých směsí
Různorodé směsi dělíme do čtyř skupin na:
- suspenze - je směs pevné a kapalné látky (např. křída a voda, písek a voda, železné piliny a voda);
- emulze - je směs kapalných látek, které se vzájemně nemísí (např. voda a olej);
- pěna - je směs plynné látky rozptýlené v kapalné látce (např. pěna ve vaně, šlehačka) nebo v pevné látce (např. pemza, houba);
- aerosol - je směs kapalné látky rozptýlené v látce plynné - mlha, nebo směs pevné látky rozptýlené v látce plynné - dým.
ROZTOKY
Roztoky jsou homogenní směsi, které se skládají z rozpouštědla a rozpuštěné látky. Největší význam mají kapalné roztoky. Nejvýznamnějším rozpouštědlem je voda - H2O.
Nasycený roztok - je takový roztok, kdy při určité teplotě a tlaku se v něm již nerozpustí více látky.
Nenasycený roztok - je takový roztok, který obsahuje menší množství rozpuštěné látky, než roztok nasycený. Jinými slovy můžeme říct, že nenasycený roztok, je takový roztok, kdy při určité teplotě a tlaku se v něm rozpustí další přidaná látka.
Rozpustnost - látky se udává jako množství rozpuštěné látky, vyjádřené v gramech, které se rozpustí ve 100 gramech rozpouštědla (nejčastěji vody) za vzniku nasyceného roztoku, při určité teplotě a tlaku.
ODDĚLOVÁNÍ SLOŽEK ZE SMĚSÍ
K oddělování složek směsí se používají různé postupy, při kterých se využívá rozdílných vlastností jednotlivých složek.
1) Přebírání (separování)
Přebírání je oddělování složek směsi pevných látek, při kterém se využívá jejich rozdílné barvy, tvaru, hmotnosti nebo magnetických vlastností.
Využití:
- třídění odpadu
- oddělování neželezných kovů od železa ve sběrných surovinách a železárnách
- rýžování zlata
Usazování je oddělování vzájemně nerozpustných složek směsi na základě jejich rozdílné hustoty.
Využití:
- čištění vody od pevných nečistot
- čištění ropy od vody a pevných nečistot
- příprava turecké kávy (usazení pevné složky směsi před pitím)
Odstřeďování
Odstřeďování je oddělení vzájemně nerozpustných složek směsi na základě jejich rozdílné hustoty, s využitím odstředivé síly. Jedná se o zrychlený proces usazování.
Nákres:
Filtrace je oddělování pevných složek z kapalných a plynných směsí na porézní přepážce -"filtru". Jako filtr se používá papír, textilie, nebo jiné porézní materiály.
Využití:
- čištění vody ve vodárnách (stěrkové a pískové filtry)
- vysávíní prachu (papírové, látkové a vodní filtry)
- vyření těstovin (oddělení vody od těstovin pomocí síta)
- příprava sypaného čaje (sítko jako filtr)
Nákres:
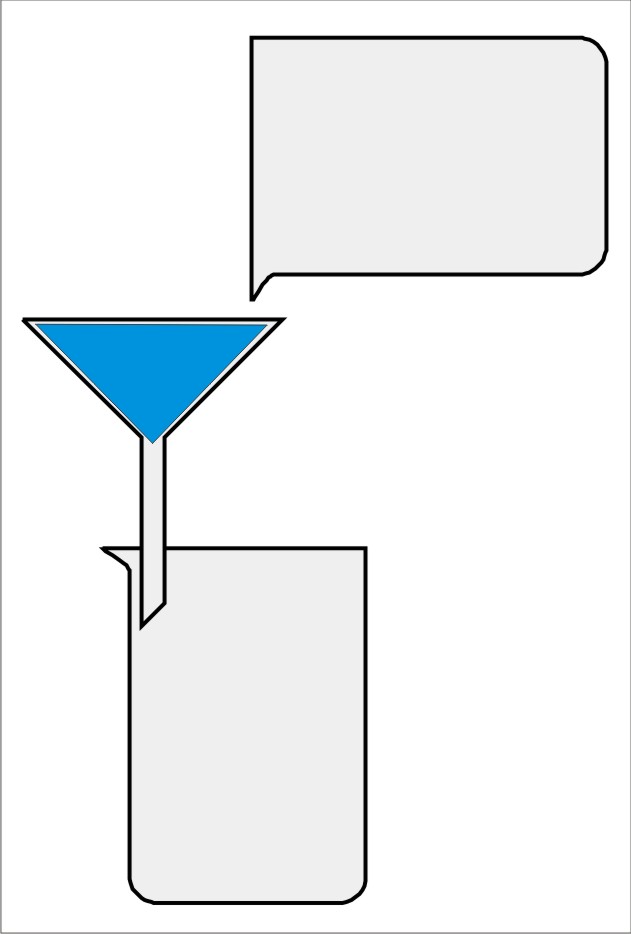
Destilace je oddělování složek stejnorodé směsi na základě rozdílných teplot varu.
Využití:
- výroba destilované vody
- výroba ethanolu (alkoholických nápojů) ze zkvašených ovocných šťáv
- výroba benzinu, nafty a petroleje z ropy
- oddělení vonných silic pro výrobu parfémů
Nákres:
5) Krystalizace
Krystalizace je oddělování rozpuštěných složek stejnorodé směsi, při které dochází k vyloučení pevné složky v podobě krystalů. Krystalizaci můžeme urychlit uvedením směsi k varu, krátkým povaření a následně prudkým ochlazením.
Využití:
- získávání soli z mořské vody
- čištění krystalických látek
Vyluhování je oddělení složek směsi na základě jejich rozdílné rozpustnosti v určitém rozpouštědle.
Využití:
- získávání barviv z přírodních materiálů
- získávání léčivých látek z rostlin
Sublimace je oddělení směsi pevných látek, kdy jedna má schopnost sublimovat, tj. přecházet z pevného skupenství do skupenství plynného.
Využití:
- čištění pevných sublimujících látek, např. jód
Chromatografie je oddělování složek směsi na základě jejich rozdílné schopnosti vázat se ke dvěma látkám, s nimiž jsou ve styku. Jedna látka bývá pevná a druhá látka je rozpouštědlo.
Využití:
- získávání barviv z rostlinných směsí
- zjišťování chemických látek přidávaných do potravin
- získávání léčiv z rostlin
HMOTNOSTNÍ ZLOMEK
Hmotnostní zlomek - je číselný údaj, udávající poměr rozpuštěné látky k celkové hmotnosti roztoku. Značí se w. Vyjadřuje se:
a) zlomkem 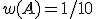
b) v procentech (w=10%, kde 1% je 0,01 celku)
c) desetiným číslem (w=0,1)
V praxi používáme nejčastěji vyjádření hmotnostního zlomku v %.
Hmotnostní zlomek vypočítáme podle vzorce:
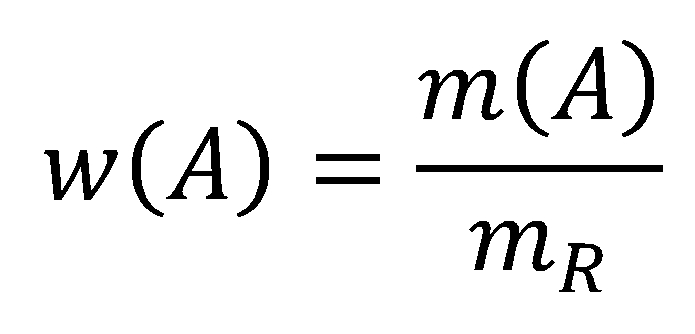
kde
w(A) označuje hmotnostní zlomek látky A v roztoku,
m(A) je hmotnost rozpuštěné látky A v roztoku,
mR je hmotnost celého roztoku (tzn. hmotnost rozpouštědla a hmotnost rozpuštěné látky).
mR=m(A)+mrozpouštědla
Příklad 1
Vypočítejte hmotnostní zlomek vodného roztoku chloridu sodnho (NaCl), který byl připraven rozpuštěním 30g chloridu sodného v 90g vody (H2O).
m(NaCl) = 30g
m(H2O) = 90g
w(NaCl) = ?
w(NaCl) = m(NaCl) / mR
mR = m(NaCl) + m(H2O)
mR = 30 + 90 = 120
mR = 120g
w(NaCl) = 30 / 120 = 0,25
0,25 · 100 = 25%
w(NaCl) = 25%
Hmotnostní zlomek chloridu sodného v roztoku je 25 %.
Příklad 2
Kolik gramů síranu železnatého (FeSO4) obsahuje 200g vodného roztoku o hmotnostním zlomku 15 %?
w(FeSO4) = 15% = 0,15
mR = 200g
m(FeSO4) = ?
w(FeSO4) = m(FeSO4) / mR => m(FeSO4) = w(FeSO4) · mR
m(FeSO4) = 0,15 · 200 = 30
m(FeSO4) = 30g
Roztok obsahuje 30g síranu železnatého.
Příklad 3
V kolika gramech vody (H2O) musíme rozpustit 25g hydroxidu sodného (NaOH), abychom získali 10% vodný roztok?
m(NaOH) = 25g
w(NaOH) = 10% = 0,1
m(H2O) = ?
w(NaOH) = m(NaOH) / mR => mR = m(NaOH) / w(NaOH)
mR = m(NaOH) + m(H2O) => m(H2O) = mR - m(NaOH)
mR = 25 / 0,1 = 250
mR = 250g
m(H2O) = 250 - 25 = 225
m(H2O) = 225g
Abychom získali 10% roztok hydroxidu sodného, musíme 25g hydroxidu sodného rozpustit v 225g vody.
Ing. Lubor Hajduch ZŠ Vančurova 2, Hodonín